- トップページ
- 治験 発ケン!広島県
- 医薬品の開発に関わる規制について
医薬品の開発に関わる規制について
治験に関わる規制
治験に関わる規制は、以下のものです。
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(昭和35年法律第145号)
(略称:「医薬品医療機器法」。旧「薬事法」)
「医薬品の臨床試験の実施の基準に関する省令」(GCP省令)(平成9年厚生省令第28号)
これらは「法令」と呼ばれるものです。参考に法律の階層について、概念図を下記に示します。
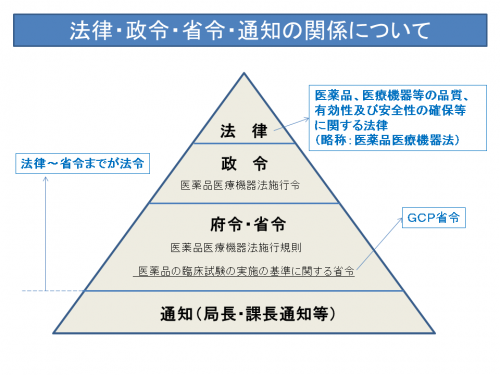
法令とは、法律(国会が制定する法規範)と命令(行政機関が制定する法規範)を合わせて呼ぶ法用語です。治験に関わる法律は「医薬品医療機器法」であり、治験の実施については「GCP省令」でその基準が定められていますので、仮にこのGCP省令の定めに従わない場合には違法となり、罰則が科せられることになります。
※ 治験に関わる法律の改正について
平成26年まで「薬事法」という法律でしたが、法改正によって法律の名前が改称,「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」になりました。略して「医薬品医療機器法」,あるいは「薬機法」と呼ぶこともあります。
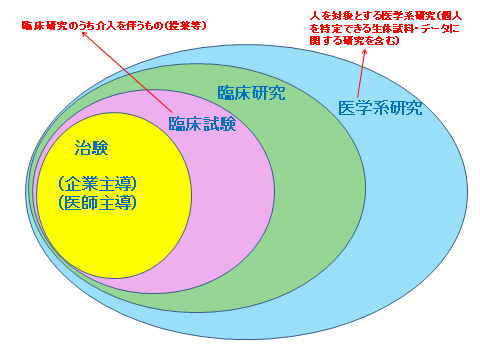
「治験」と「臨床研究」の区分について
下に治験と臨床研究の区分について概念図を示しました。医薬品・医療機器の製造販売承認を取得するための臨床試験が「治験」。治験以外で人を対象とする医学系研究が「臨床研究」です。臨床データの収集など、介入(投薬等)を伴わない場合も含めて定義されています。
臨床研究に関わる規制
臨床研究に関わる規制については、治験と異なり規制する法令はありません。臨床研究に関わる規制は、「人を対象とする医学系研究の倫理指針」 (平成26年文部科学省・厚生労働省告示第3号)です。
詳しくはこちら→臨床研究に関する倫理指針 (PDFファイル)(147KB)
※ 参考厚生労働省ホームページ
PDF形式のファイルをご覧いただく場合には、Adobe社が提供するAdobe Readerが必要です。
Adobe Readerをお持ちでない方は、バナーのリンク先からダウンロードしてください。(無料)
